De relatie tussen de darm- en orale microbiomen en hun impact op de algehele gezondheid
Het microbioom en de gehele microbioomcultuur zijn een opkomend gebied van belang in de medische gezondheid en welzijn. Een microbioom op zich is een complex ecosysteem dat bestaat uit talloze micro-organismen die zich in en rond het menselijk lichaam bevinden en in wisselwerking staan met bijna alle lichaamssystemen.
Algemene kennis benadrukt de rol van het darmmicrobioom bij de spijsvertering, het metabolisme en immuungerelateerde functies; De relatie met het orale microbioom is echter even opmerkelijk, maar niet goed begrepen. De twee microbiële gemeenschappen zijn verschillend en ruimtelijk gescheiden.
Niettemin zijn ze nauw met elkaar verbonden en van fundamenteel belang voor het behoud van de algehele gezondheid.
Het begrijpen van de delicate mechanismen die onder het microbioom liggen, is van fundamenteel belang om een grondig perspectief op het algemene welzijn te krijgen.
Het microbioom
De term microbioom omvat de microben, hun genetische informatie en de omgeving waarin ze met elkaar omgaan. Er is verondersteld dat de Nobelprijswinnaar Joshua Lederberg de term microbioom heeft bedacht (Hooper & Gordon, 2001), die het totale genoom vertegenwoordigt van symbiotische gemeenschappen die met de gastheer zijn geassocieerd.
Het microbioom wordt beschouwd als "de biotische en abiotische habitat die bestaat uit de gemeenschap van micro-organismen die verband houden met een bepaalde omgeving of gastheer. Soms synoniem met "microbiota", hoewel er is beweerd dat dit laatste moet worden gereserveerd voor op markergenen gebaseerde beschrijvingen van de biotische component van het microbioom" (Marchesi & Ravel, 2015).
Recente studies hebben binnen het menselijke darmmicrobioom tussen de 90.000 en 150.000 verschillende microbiële stammen geïdentificeerd in twee grote meta-analyses (Almeida et al., 2019; Pasolli et al., 2019). Geschat wordt dat elk individu tussen de 150 en 400 inwonende bacteriesoorten in het darmkanaal heeft (Mall et al., 2017). Deze gegevens zijn verkregen door middel van zowel cultuurafhankelijke als cultuuronafhankelijke technieken (Lloyd-Price et al., 2016).
Deze onderlinge interactie tussen de microbiële en menselijke genen van zoveel microbiële soorten heeft een grote invloed op de gezondheid en fysiologie:
Het concept van een 'uitgebalanceerd darmmicrobioom' of eubiose is essentieel voor de darmgezondheid. Dit wordt gevormd door een aanzienlijke kolonisatie van de bacteriële phyla Firmicutes en Bacteroides, terwijl potentieel schadelijke soorten, zoals de Proteobacteria phylum (inclusief Enterobacteriaceae), schaars zijn.
Wanneer dit laatste relevanter wordt, treedt dysbiose op. Dysbiose is gecorreleerd met een breed scala aan aandoeningen, waaronder inflammatoire darmaandoeningen, stofwisselingsstoornissen en obesitas. Het begrijpen van de dynamische interactie tussen eubiose en dysbiose is van het grootste belang voor therapeutische interventies om microbiële onbalans te corrigeren.
Het is aangetoond dat de meest voorkomende en dominante phyla, die bijna 90% van de totale microbiota-populatie uitmaken, zijn: Bacteroidetes, Firmicutes, Proteobacteria, Fusobacteria, Tenericutes, Actinobacteria en Verrucomicrobia (Jethwani & Grover, 2019).
Verken een inzichtelijke discussie over het orale microbioom en de cruciale rol ervan bij het voorkomen van parodontitis en het verbeteren van de mondgezondheid. In deze aflevering deelt professor Zaura onschatbare inzichten in microbiële gemeenschappen en hun diepgaande impact op de algehele gezondheid.
Duik diep in deskundige strategieën om het orale microbioom te verbeteren en de patiëntenzorg te verbeteren.
Ontwikkeling van het darmmicrobioom
De eerste bacteriële kolonisatie van het microbioom begint tijdens de geboorte (Salazar et al., 2014). De toedieningsmethode heeft een grote invloed op de samenstelling van de darmmicrobiota van de baby. In het geval van een vaginale bevalling krijgt de pasgeborene de vaginale microbiota van de moeder, terwijl bij de keizersnede de huid van de baby grotendeels wordt bevolkt door de huidmicrobiota van de moeder, waardoor een divergende microbiële samenstelling optreedt (Clemente et al., 2012). Vervolgens wordt de darmkolonisatie sterk beïnvloed door omgevings- en voedingsfactoren.
Het eerste patroon van darmkolonisatie wordt als chaotisch beschouwd en er is een toenemende hoeveelheid bewijs dat suggereert dat vroege blootstelling aan het milieu, vooral via de voeding, erg belangrijk is bij het veroorzaken van deze variaties (Koening et al., 2011). In de vroege stadia beginnen aërobe bacteriën, zoals enterokokken, stafylokokken en streptokokken , het darmkanaal te koloniseren, waardoor de omgeving ontstaat waaraan een meer anaërobe microbiële gemeenschap zich kan hechten (Pop, 2012).
De ontwikkeling van het darmmicrobioom en het immuunsysteem van baby's zal dus sterk worden beïnvloed door spenen, borstvoeding en de geleidelijke introductie van verschillende voedingsmiddelen (Schwartz et al., 2012).
Voederen
Moedermelk is niet steriel, maar herbergt tot 600 soorten bacteriën, waaronder enkele nuttige soorten zoals Bifidobacterium breve, Bifidobacterium adolescentis, Bifidobacterium longum en Bifidobacterium bifidum . Deze micro-organismen zijn verantwoordelijk voor de vorming van een gezonde darmmicrobiota bij het kind en de opkomst van een adequaat immuunsysteem (Martín et al., 2009). Belangrijk is dat baby's die borstvoeding krijgen een hoger aantal bifidobacteriën vertonen dan zuigelingen die flesvoeding krijgen. Een van de voordelen van borstvoeding ten opzichte van flesvoeding is inderdaad de aanwezigheid van oligosachariden. Deze oligosacchariden zijn prebiotica die bevorderlijk zijn voor een positieve bacteriële gemeenschap, waardoor beschermende witte bloedcellen in de darm worden geactiveerd (Balmer & Wharton, 1989).
Bifidobacteriën remmen de kolonisatie van pathogene bacteriën en dragen bij tot de algemene gezondheid van de darm (Fukuda et al., 2011).
Bifidobacteriën zijn verantwoordelijk voor de versterking van de darmslijmvliesbekleding, meestal door de pathogene micro-organismen niet toe te staan te koloniseren, immuunresponsen te bevorderen en qua voedingswaarde te concurreren met pathologische bacteriesoorten. Bovendien verhoogt de aanwezigheid van bifidobacteriën het niveau van immunoglobuline A aanzienlijk, dat verklevingen van ziekteverwekkers aan de darmwand voorkomt, wat leidt tot een versterking van het darmimmuunsysteem (Ouwehand et al., 2002).
Veranderingen in het darmmicrobioom met de leeftijd
De samenstelling van de darmmicrobiota ondergaat aanzienlijke veranderingen tijdens de vroege stadia van ontwikkeling, zoals blijkt uit metagenomische analyses. Verschillende factoren beïnvloeden deze veranderingen, waaronder voeding een belangrijke en belangrijke rol speelt (Koenig et al., 2011). Zelfs bij pasgeborenen kan het effect van voeding op het darmmicrobioom worden waargenomen. Tijdens de vroege stadia vertoont het microbioom een minimale diversiteit en biedt het dieet voedingsstoffen die de diversiteit van het microbioom in toenemende mate ondersteunen, wat helpt bij het ontwikkelen van specifieke microbiële populaties die nodig zijn voor het lactaatmetabolisme (Salazar et al., 2014).
Binnen de eerste 3 levensjaren ontwikkelt de bacteriële darmflora zich volledig. Na de voorlopige kolonisatie van Bifidobacterium-soorten zal er een meer diverse gemeenschap ontstaan met Bacteroides en Firmicutes (Ottman et al., 2012). Deze samenstelling zal tijdens het leven blijven bestaan, tenzij er lange schommelingen in de voeding of antibioticagebruik optreden.
Inderdaad, op oudere leeftijd is er vaak een toename van de variabiliteit met betrekking tot de microbiële gemeenschap (Claesson et al., 2011). Het verouderingsproces wordt in verband gebracht met een overvloed aan factoren die mogelijk de darmmicrobiota kunnen veranderen, waaronder tandverlies, veranderingen in de speekselafscheiding, langzamere spijsvertering en veranderingen in de timing van voedseldoorvoer in de darm (Lovat, 1996). Daarom wordt een toename van vezels het meest geadviseerd tijdens het ouder worden.
Dieet
Dieet is een van de belangrijkste factoren die de darmmicrobiota reguleren, en dieetaanpassingen veroorzaken drastische veranderingen in de algehele gezondheid. Een westers dieet, rijk aan vet, verwerkte suiker en lactosevrije eiwitten afkomstig van vlees, en beperkt in vezels, wordt ervan verdacht een van de belangrijkste factoren te zijn die de bacteriële diversiteit verminderen en andere nuttige soorten dan Bifidobacterium en Eubacterium verminderen (Drasar et al., 1973; Reddy et al., 1975; Wu et al., 2011). Daarom is gesuggereerd dat het mediterrane dieet, veganistische en vegetarische diëten geschikter zijn voor het ontwikkelen van een gezonde samenstelling van het darmmicrobioom. Het mediterrane dieet verhoogt de aanwezigheid van Lactobacillus, Bifidobacterium en Prevotella. Bovendien vermindert het het risico op pathogene bacteriën zoals Clostridium (Bialonska et al., 2010; Clemente et al., 2012; Fava et al., 2013; Furet et al., 2010; Koloverou et al., 2016; Queipo-Ortuño et al., 2012). Een vegetarisch dieet wordt gekenmerkt door een hogere consumptie van voedingsvezels, wat cruciaal is voor het behoud van de integriteit van de darmslijmvliesbarrièrefunctie. Dit dieet wordt in verband gebracht met een verbeterde gezondheid en veranderingen in de samenstelling van de darmmicrobiota, wat leidt tot een overwicht van Prevotella en Bacteroidetes , terwijl het afstapt van Firmicutes (Matijašić et al., 2014).
Het microbioom en metabole gezondheid: verbanden met obesitas, hart- en vaatziekten en diabetes
Het is aangetoond dat de complexe interacties tussen de darmmicrobiota en de gastheer bijdragen aan stofwisselingsstoornissen zoals obesitas en diabetes. Studies hebben een verband aangetoond tussen obesitas en lagere niveaus van Bacteroidetes (Ley et al., 2005; Turnbaugh et al., 2006). Het niveau van Bacteroidetes neemt weer toe na gewichtsverlies door een vetarm en koolhydraatarm dieet (Ley et al., 2006). Proefpersonen met diabetes hebben een verminderd aantal butyraatproducerende bacteriën (Karlsson et al., 2013; Larsen et al., 2010; Yassour et al., 2016; Zhang et al., 2013). Butyraat is verantwoordelijk voor het behoud van de darmbarrière, de afname van de systemische ontstekingsreactie en de regulatie van de insulinegevoeligheid. Naast stofwisselingsstoornissen zoals obesitas, spelen de effecten van het microbioom ook een rol bij de cardiovasculaire gezondheid, voornamelijk via de productie van microbiële metabolieten zoals TMAO (trimethylamine N-oxide). TMAO is een metaboliet die is afgeleid van de darmmicrobiota. Wanneer de concentratie de normale niveaus overschrijdt, wordt het een belangrijke factor in het cardiometabole risico (Qi et al., 2018), met een 12% verhoogd risico op het ontwikkelen van hypertensie (Ge at al., 2020) en een 62% groter risico op het ervaren van een cardiovasculaire gebeurtenis (Heianza et al., 2017).
Probiotica
De Voedsel- en Landbouworganisatie (FAO) van de Verenigde Naties en de Wereldgezondheidsorganisatie (WHO) definiëren probiotica als "levende micro-organismen die, wanneer ze in voldoende hoeveelheden worden toegediend, een gezondheidsvoordeel opleveren voor de gastheer." Probiotica worden vaak gebruikt om de homeostase van de darmmicrobiota te verbeteren, met als doel de gezondheid van de menselijke darm te behouden (Sanders et al., 2011). Aangezien darmmicrobiële gemeenschappen niet permanent zijn en kunnen worden veranderd door verschillende factoren, zoals levensstijl, voeding en antibiotica, kunnen probiotica worden gebruikt om een verscheidenheid aan darmaandoeningen te behandelen en te voorkomen. De gunstige effecten van probiotica en hun relatie met darmziekten zijn in verschillende onderzoeken aangetoond (Blaabjerg et al., 2017; Hilty et al., 2010; Yang & Yu, 2018).
De orale-darm-as: interacties tussen darm- en orale microbiota
Het orale microbioom bestaat uit een zeer diverse gemeenschap van bacteriën, schimmels, archaea en virussen, die een cruciale en belangrijke rol spelen bij het behoud van zowel de orale als de systemische gezondheid. Onder omstandigheden van blootstelling aan risicofactoren zoals slechte mondhygiëne, roken en diabetes, kan dysbiose van dit microbioom leiden tot parodontitis en cariës. Literatuur geeft aan dat orale microbioomdysbiose de samenstelling van het darmmicrobioom beïnvloedt, waardoor de kans op systemische en darmontsteking en metabole stoornissen toeneemt. Deze interactie benadrukt het belang van het handhaven van het evenwicht van het orale microbioom om gezondheidsrisico's op grotere schaal te verminderen.
Het orale microbioom bevat meer dan 770 bacteriesoorten, voornamelijk behorend tot Actinomycetota, Bacteroidota (Bacteroidetes), Bacillota (Firmicutes), Fusobacteriota (Fusobacteriën), Pseudomonadota (Proteobacteriën), Saccharibacteriën (TM7) en Spirochaetota (Spirochaetes), die een van de rijkste en meest diverse microbiële gemeenschappen in het menselijk lichaam vormen (Escapa et al., 2018). Bovendien bevat het orale microbioom niet alleen bacteriën; de aanwezigheid van micro-eukaryoten (schimmels, amoeben en flagellaten), archaea en virussen is ook belangrijk, aangezien er meer dan 100 geslachten van schimmels in het orale microbioom zijn (Diaz et al., 2017; Diaz & Dongari-Bagtzoglou, 2021; Ghannoum et al., 2010), voornamelijk vertegenwoordigd door soorten Candida en Malassezia (Dupuy et al., 2014; Gabaldón et al., 2013; Hong et al., 2020).
Interessant is dat de mondholte tal van micro-omgevingen bevat die verschillende microbiële gemeenschappen herbergen. Deze microbiële gemeenschappen zijn geëvolueerd om deze specifieke niches te bezetten. Geslachten zoals Fusobacterium, Veillonella en Prevotellaceae omvatten bijvoorbeeld verschillende soorten die in staat zijn om verschillende micro-omgevingen in de mondholte te koloniseren, zoals de tong, gingiva of tandplak (Eren et al., 2014; Mark Welch op al., 2019).
Het belang van de orale microbiota kan niet genoeg worden benadrukt, aangezien twee van de meest voorkomende ziekten wereldwijd, cariës en parodontitis, te wijten zijn aan de dysbiose. Bij de ontwikkeling van cariës wordt een belangrijke rol gespeeld door S. mutans, een soort die in staat is tot biofilmvorming en zuurproductie. Lactobacillen, Veillonella en C. albicans spelen echter ook een belangrijke rol in de pathogenese van cariës (Simón-Soro & Mira, 2015). Bij de ontwikkeling van parodontitis is de noodzakelijke voorwaarde voor het ontstaan van de pathologie de ophoping van bacteriële plaque in de vorm van een biofilm aan de tandvleesrand (Mombelli, 2003). Recente studies hebben aangetoond dat, naast de bacteriële taxa die traditioneel worden geassocieerd met parodontitis (Porphyromonas-, Treponema- en Tannerella-soorten ), Filifactor alocis, Peptoanaerobacter stomatis en Saccharibacteria potentiële parodontale pathogenen zijn (Miralda & Uriarte, 2021). In het geval van dysbiose in de mondholte als gevolg van risicofactoren zoals roken, diabetes, slechte en verkeerde mondhygiëne of een ongezond dieet, neemt het niveau van parodontopathogene bacteriën aanzienlijk toe, wat leidt tot een reactief ontstekingsproces van de parodontale weefsels (Scannapieco & Dongari-Bagtzoglou, 2021). Bovendien is aangetoond dat parodontitis ook de kans op het ontwikkelen van talrijke en significante systemische aandoeningen zoals atherosclerotische aandoeningen, auto-immuunziekten, tumoren en diabetes verhoogt (Hajishengallis, 2022).
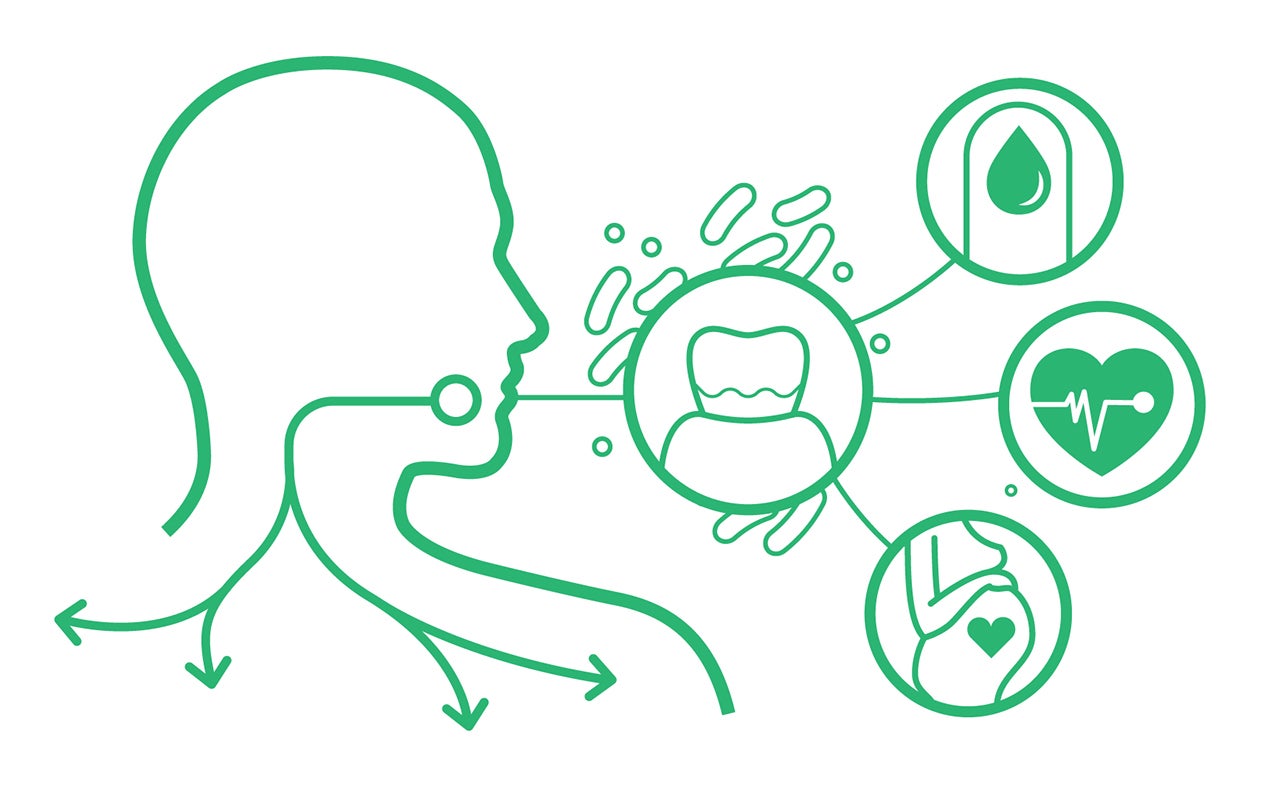
De orale en de darmmicrobiota zijn geen afzonderlijke entiteiten. De mondholte en het darmkanaal hebben overeenkomsten in veel aspecten, zoals microbiële samenstelling, anatomische slijmvliesstructuur en immunologische afweer. Deze gemeenschappelijke kenmerken geven aan dat darmziekten en orale pathologieën met elkaar verbonden kunnen zijn. Uit verschillende studies is inderdaad gebleken dat orale bacteriën het darmkanaal kunnen koloniseren en zo een integraal onderdeel kunnen worden van de darmmicrobiota (Lwauchi et al., 2019; Kageyama et al., 2017; Schmidt et al., 2019). Deze darm-tandvlees-as lijkt verbonden te zijn via speeksel-, hematogene en enterale routes.
Dienovereenkomstig transporteert speeksel enzymen, cytokines, ontstekingscellen en bacteriën. De aanwezigheid van speekselslijm beschermt deze componenten tegen maagzuur, waardoor ze het darmkanaal kunnen bereiken . Bovendien kunnen bacteriën de darmwanden bereiken door hematogene verspreiding. Het is algemeen bekend dat orale mechanische verwondingen door routinematige activiteiten zoals intensief kauwen of poetsen, evenals tandheelkundige ingrepen zoals gebitsreiniging, de kans kunnen vergroten dat orale bacteriën in de systemische circulatie terechtkomen, vooral bij personen met parodontitis (Lockhart et al., 2008; Parahitiyawa et al., 2009).
De verspreiding van orale microben naar de darm kan verschillende gastro-intestinale aandoeningen verergeren, zoals het prikkelbare darmsyndroom, inflammatoire darmaandoeningen en colorectale kanker. Een onderzoek naar inflammatoire darmaandoeningen wees uit dat colonbiopten de aanwezigheid aantoonden van Fusobacterium, Peptostreptococcus, Staphylococcus en Streptococcus, veel voorkomende bewoners van de orale microbiota (Dinakaran et al., 2019). Patiënten met ernstige parodontitis vertonen zelfs dysbiose in hun darmmicrobiota (Amado et al., 2020; Kawamoto et al., 2021).
Bovendien vertoonden patiënten met de ziekte van Crohn en colitis ulcerosa meer overeenkomsten tussen het orale en darmmicrobioom in vergelijking met gezonde individuen. Dit suggereert verder een verband tussen parodontitis en inflammatoire darmaandoeningen. De darmkolonisatie van de pathogene orale bacterie Haemophilus parainfluenzae bij parodontitis is gekoppeld aan darmontsteking bij patiënten met de ziekte van Crohn. Daarom kunnen personen met vroeg optredende vormen van parodontitis ernstigere symptomen van de ziekte van Crohn ervaren (Imai et al., 2021); Sohn et al., 2023).
Er is ook verondersteld dat dysbiose van de darmmicrobiota de ontwikkeling van parodontitis beïnvloedt, aangezien inflammatoire darmaandoeningen een risicofactor zijn voor parodontitis (Chandan & Thomas, 2017). Dit kan gebaseerd zijn op het feit dat dysbiose van de darmmicrobiota de functie van de darmbarrière verandert, het immuunsysteem verstoort en leidt tot verhoogde niveaus van systemische ontsteking en daarom het glucose- en lipidenmetabolisme beïnvloedt. Het kan de kans op het ontwikkelen van verschillende systemische ziekten vergroten (Jepsen et al., 2018).
Ten slotte is het vermeldenswaard dat na parodontale behandeling de samenstelling van zowel de orale als de intestinale microbiota bij parodontale patiënten sterk leek op die van parodontaal gezonde patiënten (Baima et al., 2024).