La relación entre los microbiomas intestinales y orales y su impacto en la salud general
El microbioma y todo el cultivo del microbioma son un área emergente de importancia en la salud y el bienestar médicos. Un microbioma per se es un ecosistema complejo compuesto por innumerables microorganismos que residen dentro y alrededor del cuerpo humano, interactuando con casi todos los sistemas corporales.
El conocimiento común enfatiza el papel del microbioma intestinal en la digestión, el metabolismo y las funciones relacionadas con el sistema inmunológico; Sin embargo, su relación con el microbioma oral es igualmente notable, pero no se comprende bien. Las dos comunidades microbianas son distintas y están separadas espacialmente.
Sin embargo, están estrechamente relacionados y son fundamentales para mantener la salud en general.
La comprensión de los delicados mecanismos que subyacen al microbioma es fundamental para obtener una perspectiva completa del bienestar general.
El microbioma
El término microbioma engloba a los microbios, su información genética y el entorno en el que interactúan. Se ha planteado la hipótesis de que el premio Nobel Joshua Lederberg acuñó el término microbioma (Hooper y Gordon, 2001), que representa el genoma total de las comunidades simbióticas asociadas al huésped.
El microbioma se considera "el hábitat biótico y abiótico que comprende la comunidad de microorganismos asociados con un entorno o huésped particular. A veces se considera sinónimo de "microbiota", aunque se ha argumentado que esta última debería reservarse para las descripciones, basadas en genes marcadores, del componente biótico del microbioma" (Marchesi y Ravel, 2015). un entorno o huésped determinado.
Estudios recientes han identificado, dentro del microbioma intestinal humano, entre 90.000 y 150.000 cepas microbianas distintas en dos grandes metaanálisis (Almeida et al., 2019; Pasolli et al., 2019). Se estima que cada individuo tiene entre 150 y 400 especies bacterianas residentes en el tracto intestinal (Mall et al., 2017). Estos datos se obtuvieron mediante técnicas tanto dependientes como independientes del cultivo. (Lloyd-Price et al., 2016).
Esta interacción mutua entre los genes microbianos y humanos de tantas especies microbianas afecta en gran medida a la salud y la fisiología:
El concepto de un "microbioma intestinal equilibrado", o eubiosis, es esencial para la salud intestinal. Está constituida por una importante colonización de los filos bacterianos Firmicutes y Bacteroides, mientras que las especies potencialmente dañinas, como el filo Proteobacteria (incluyendo Enterobacteriaceae), son escasas.
Cuando estos últimos adquieren mayor relevancia, se produce la disbiosis. La disbiosis se ha correlacionado con una amplia gama de afecciones, incluidas las enfermedades inflamatorias intestinales, los trastornos metabólicos y la obesidad. Comprender la interacción dinámica entre la eubiosis y la disbiosis es de suma importancia para las intervenciones terapéuticas que corrijan el desequilibrio microbiano.
Se ha demostrado que los filos más prevalentes y dominantes, que constituyen casi el 90% de la población total de microbiota, son: Bacteroidetes, Firmicutes, Proteobacteria, Fusobacteria, Tenericutes, Actinobacteria y Verrucomicrobia (Jethwani & Grover, 2019).
Explore una interesante conversación sobre el microbioma oral y su papel crucial en la prevención de enfermedades periodontales y la mejora de la salud bucal. En esta entrevista, la profesora Zaura comparte información de alto valor sobre las comunidades microbianas y su profundo impacto en la salud en general.
Profundice en las estrategias de los expertos sobre cómo mejorar el microbioma oral y la atención al paciente.
¡Descúbralo en el siguiente video!
Versión original en inglés con opción a activar subtítulos en castellano.
Desarrollo del microbioma intestinal
La colonización bacteriana inicial del microbioma comienza durante el parto (Salazar et al., 2014). El método de nacimiento influye en gran medida en la composición de la microbiota intestinal infantil. En el caso de un parto vaginal, el recién nacido adquiere la microbiota vaginal de la madre, mientras que en la cesárea la piel del lactante está poblada en su mayor parte por la microbiota cutánea materna, por lo que se produce una composición microbiana divergente (Clemente et al., 2012). Posteriormente, la colonización intestinal se ve muy afectada por factores ambientales y dietéticos.
Se cree que el primer patrón de colonización intestinal es caótico, y cada vez hay más pruebas que sugieren que las exposiciones ambientales tempranas, especialmente a través de la dieta, son muy importantes para causar estas variaciones (Koening et al., 2011). En las primeras etapas, las bacterias aeróbicas, como los enterococos, los estafilococos y los estreptococos , comienzan a colonizar el tracto intestinal, creando el entorno al que puede adherirse una comunidad microbiana más anaeróbica (Pop, 2012).
Por lo tanto, el desarrollo del microbioma intestinal y el sistema inmunitario del lactante se verá fuertemente influenciado por el destete, la lactancia y la introducción gradual de diferentes alimentos (Schwartz et al., 2012).
Alimentación
La leche materna no es estéril, alberga hasta 600 especies de bacterias, entre las que se pueden encontrar algunas especies beneficiosas como Bifidobacterium breve, Bifidobacterium adolescentis, Bifidobacterium longum y Bifidobacterium bifidum . Estos microorganismos son los responsables de la formación de una microbiota intestinal sana en el lactante y del surgimiento de un sistema inmunitario adecuado (Martín et al., 2009). Es importante destacar que los bebés amamantados muestran un mayor número de bifidobacterias que los bebés alimentados con fórmula. De hecho, una de las ventajas de la lactancia materna sobre la alimentación con fórmula es la presencia de oligosacáridos. Estos oligosacáridos son prebióticos que conducen a una comunidad bacteriana positiva, desencadenando glóbulos blancos protectores en el intestino (Balmer y Wharton, 1989).
Las bifidobacterias inhiben la colonización de bacterias patógenas y contribuyen a la salud general del intestino (Fukuda et al., 2011).
Las bifidobacterias son responsables del fortalecimiento de la mucosa intestinal principalmente al impedir que los microorganismos patógenos colonicen, al promover respuestas inmunitarias y competir nutricionalmente con las especies bacterianas patológicas. Además, la presencia de bifidobacterias aumenta significativamente el nivel de inmunoglobulina A, lo que evita la adhesión de patógenos a la pared intestinal, conduciendo a una mejora del sistema inmunológico intestinal (Ouwehand et al., 2002).
Cambios en el microbioma intestinal con la edad
La composición de la microbiota intestinal experimenta cambios significativos durante las primeras etapas del desarrollo, como se observa a través de los análisis metagenómicos. Diversos factores influyen en estos cambios, entre los cuales la dieta juega un papel importante y significativo (Koenig et al., 2011). Incluso en los recién nacidos, se puede observar el efecto de la dieta en el microbioma intestinal. Durante las primeras etapas, el microbioma muestra una diversidad mínima y la dieta proporciona nutrientes que apoyan cada vez más la diversidad del microbioma, lo que ayuda a desarrollar poblaciones microbianas específicas necesarias para el metabolismo del lactato (Salazar et al., 2014).
Dentro de los primeros 3 años de vida, la flora intestinal bacteriana se desarrolla completamente. Después de la colonización preliminar de las especies de Bifidobacterium , se producirá una comunidad más diversa poblada con Bacteroides y Firmicutes (Ottman et al., 2012). Esta composición prevalecerá durante la vida a menos que ocurran fluctuaciones dietéticas prolongadas o el uso de antibióticos.
De hecho, en la vejez, a menudo hay un aumento en la variabilidad con respecto a la comunidad microbiana (Claesson et al., 2011). El proceso de envejecimiento está asociado a una gran cantidad de factores que pueden alterar la microbiota intestinal, como la pérdida de dientes, los cambios en la secreción salival, la digestión más lenta y los cambios en el momento del tránsito de los alimentos en el intestino (Lovat, 1996). Por lo tanto, lo más recomendable es un aumento de fibra durante el envejecimiento.
Dieta
La dieta es uno de los principales factores que regulan la microbiota intestinal, y las modificaciones dietéticas provocan cambios drásticos en la salud general. Se sospecha que una dieta occidental, rica en grasas, azúcar procesado y proteínas sin lactosa derivadas de la carne, y limitada en fibras, es uno de los factores clave que reducen la diversidad bacteriana y disminuyen las especies beneficiosas distintas de Bifidobacterium y Eubacterium (Drasar et al., 1973; Reddy et al., 1975; Wu et al., 2011). Por lo tanto, la dieta mediterránea, las dietas veganas y vegetarianas se han sugerido como más apropiadas para desarrollar una composición saludable del microbioma intestinal. La dieta mediterránea aumenta la presencia de Lactobacillus, Bifidobacterium y Prevotella. Además, disminuye el riesgo de bacterias patógenas como Clostridium (Bialonska et al., 2010; Clemente et al., 2012; Fava et al., 2013; Furet et al., 2010; Koloverou et al., 2016; Queipo-Ortuño et al., 2012). Una dieta vegetariana se caracteriza por un mayor consumo de fibra dietética, que es crucial para mantener la integridad de la función de barrera de la mucosa intestinal. Esta dieta se asocia con una mejora de la salud y cambios en la composición de la microbiota intestinal, lo que lleva a un predominio de Prevotella y Bacteroidetes y un alejamiento de Firmicutes (Matijašić et al., 2014).
El microbioma y la salud metabólica: conexiones con la obesidad, las enfermedades cardiovasculares y la diabetes
Se ha demostrado que las complejas interacciones entre la microbiota intestinal y el huésped contribuyen a trastornos metabólicos como la obesidad y la diabetes. Los estudios han demostrado una asociación entre la obesidad y los niveles más bajos de Bacteroidetes (Ley et al., 2005; Turnbaugh et al., 2006). El nivel de Bacteroidetes aumenta de nuevo después de la pérdida de peso a través de una dieta baja en grasas y carbohidratos (Ley et al., 2006). Los sujetos con diabetes tienen un número reducido de bacterias productoras de butirato (Karlsson et al., 2013; Larsen et al., 2010; Yassour et al., 2016; Zhang et al., 2013). El butirato es responsable del mantenimiento de la barrera intestinal, la disminución de la respuesta inflamatoria sistémica y la regulación de la sensibilidad a la insulina. Además de los trastornos metabólicos como la obesidad, los efectos del microbioma también influyen en la salud cardiovascular, principalmente a través de la producción de metabolitos microbianos como el TMAO (N-óxido de trimetilamina). El TMAO es un metabolito derivado de la microbiota intestinal. Cuando su concentración supera los niveles normales, se convierte en un factor significativo en el riesgo cardiometabólico (Qi et al., 2018), mostrando un 12% más de riesgo de desarrollar hipertensión (Ge et al., 2020) y un 62% más de riesgo de experimentar un evento cardiovascular (Heianza et al., 2017).
Probióticos
La Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y la Organización Mundial de la Salud (OMS) definen a los probióticos como "microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped". Los probióticos se utilizan habitualmente para mejorar la homeostasis de la microbiota intestinal, con el objetivo de mantener la salud intestinal humana (Sanders et al). Como las comunidades microbianas intestinales no son permanentes y pueden ser alteradas por diversos factores como el estilo de vida, la dieta y los antibióticos, los probióticos se pueden utilizar para tratar y prevenir una variedad de trastornos intestinales. Los efectos beneficiosos de los probióticos y su relación con las enfermedades intestinales se han demostrado en diversos estudios (Blaabjerg et al., 2017; Hilty et al., 2010; Yang y Yu, 2018).
El eje oral-intestinal: interacciones entre la microbiota intestinal y la oral
El microbioma oral está compuesto por una comunidad muy diversa de bacterias, hongos, arqueas y virus, que desempeñan un papel crucial y significativo en el mantenimiento de la salud bucal y sistémica. En condiciones de exposición a factores de riesgo como la mala higiene bucal, el tabaquismo y la diabetes, la disbiosis de este microbioma puede provocar enfermedades periodontales y caries. La literatura indica que la disbiosis del microbioma oral afecta a la composición del microbioma intestinal, aumentando la probabilidad de inflamación sistémica e intestinal, así como de alteraciones metabólicas. Esta interacción pone de manifiesto la importancia de mantener el equilibrio del microbioma oral para reducir los riesgos para la salud a una escala más amplia.
El microbioma oral contiene más de 770 especies bacterianas, pertenecientes principalmente a Actinomycetota, Bacteroidota (Bacteroidetes), Bacillota (Firmicutes), Fusobacteriota (Fusobacteria), Pseudomonadota (Proteobacteria), Saccharibacteria (TM7) y Spirochaetota (Spirochaetes), constituyendo una de las comunidades microbianas más ricas y diversas del cuerpo humano (Escapa et al., 2018). Además, el microbioma oral no solo contiene bacterias; la presencia de microeucariotas (hongos, amebas y flagelados), arqueas y virus también es significativa, ya que hay más de 100 géneros de hongos en el microbioma oral (Díaz et al., 2017; Díaz y Dongari-Bagtzoglou, 2021; Ghannoum et al., 2010), representados predominantemente por especies de Candida y Malassezia (Dupuy et al., 2014; Gabaldón et al., 2013; Hong et al., 2020).
Curiosamente, la cavidad oral contiene numerosos microambientes que albergan diversas comunidades microbianas. Estas comunidades microbianas han evolucionado para ocupar estos nichos específicos. Por ejemplo, géneros como Fusobacterium, Veillonella y Prevotellaceae incluyen diferentes especies capaces de colonizar distintos microambientes dentro de la cavidad oral, como la lengua, la encía o la placa dental (Eren et al., 2014; Mark Welch en al., 2019).
No se puede insistir lo suficiente en la importancia de la microbiota oral, ya que dos de las enfermedades más comunes a nivel mundial, la caries y la periodontitis, se deben a su disbiosis. En el desarrollo de la caries, S. mutans, una especie capaz de formación de biopelículas y producción de ácido, desempeña un papel importante. Sin embargo, los lactobacilos, Veillonella y C. albicans también juegan un papel importante en la patogénesis de la caries (Simón-Soro y Mira, 2015). En el desarrollo de la periodontitis, la condición necesaria para la aparición de la patología es la acumulación de placa bacteriana en forma de biofilm en el margen gingival (Mombelli, 2003). Estudios recientes han demostrado que, además de los taxones bacterianos tradicionalmente asociados con la enfermedad periodontal (especies de Porphyromonas, Treponema y Tannerella ), Filifactor alocis, Peptoanaerobacter stomatis, y Saccharibacteria son potenciales patógenos periodontales (Miralda y Uriarte, 2021). En caso de disbiosis en la cavidad bucal debido a factores de riesgo como el tabaquismo, la diabetes, una higiene bucal deficiente e incorrecta o una dieta poco saludable, el nivel de bacterias periodontopatógenas aumenta significativamente, lo que conduce a un proceso inflamatorio reactivo de los tejidos periodontales (Scannapieco & Dongari-Bagtzoglou, 2021). Además, se ha demostrado que la enfermedad periodontal también aumenta la probabilidad de desarrollar numerosas e importantes afecciones sistémicas como enfermedades ateroscleróticas, trastornos autoinmunes, tumores y diabetes (Hajishengallis, 2022).
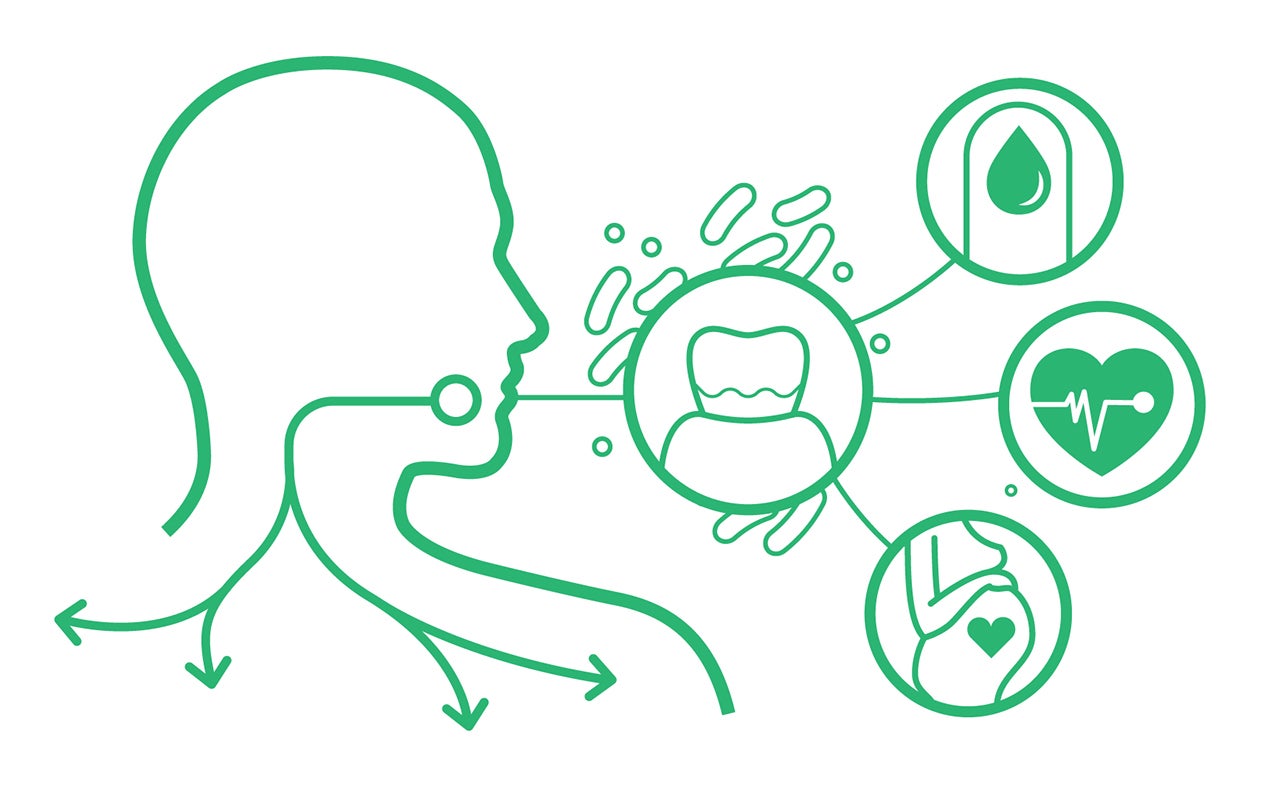
La microbiota oral y la microbiota intestinal no son entidades separadas. La cavidad oral y el tracto intestinal comparten similitudes en muchos aspectos, como la composición microbiana, la estructura anatómica de la mucosa y las defensas inmunológicas. Estas características compartidas indican que las enfermedades intestinales y las patologías bucales podrían estar interconectadas. De hecho, varios estudios han descubierto que las bacterias orales pueden colonizar el tracto intestinal y, por lo tanto, convertirse en un componente integral de la microbiota intestinal (Lwauchi et al., 2019; Kageyama et al., 2017; Schmidt et al., 2019). Este eje intestino-encía parece estar conectado a través de la saliva, las vías hematógenas y enterales.
En consecuencia, la saliva transporta enzimas, citocinas, células inflamatorias y bacterias. La presencia de moco salival protege a estos componentes del ácido gástrico, permitiéndoles llegar al tracto intestinal. Además, las bacterias pueden llegar a las paredes intestinales a través de la diseminación hematógena. Es bien sabido que las lesiones mecánicas orales causadas por actividades rutinarias como la masticación o el cepillado intensos, así como procedimientos dentales como la limpieza dental, pueden aumentar la posibilidad de que las bacterias orales ingresen a la circulación sistémica, particularmente en sujetos afectados por la enfermedad periodontal (Lockhart et al., 2008; Parahitiyawa et al., 2009).
La diseminación de microbios orales al intestino puede agravar diversas enfermedades gastrointestinales, como el síndrome del intestino irritable, la enfermedad inflamatoria intestinal y el cáncer colorrectal. Un estudio sobre la enfermedad inflamatoria intestinal observó que las biopsias de colon mostraban la presencia de Fusobacterium, Peptostreptococcus, Staphylococcus y Streptococcus, habitantes comunes de la microbiota oral (Dinakaran et al., 2019). De hecho, los pacientes con periodontitis grave presentan disbiosis en su microbiota intestinal (Amado et al., 2020; Kawamoto et al., 2021).
Además, los pacientes con enfermedad de Crohn y colitis ulcerosa mostraron más similitudes entre el microbioma oral e intestinal en comparación con los individuos sanos. Esto sugiere además una asociación entre la enfermedad periodontal y la enfermedad inflamatoria intestinal. La colonización intestinal de la bacteria oral patógena Haemophilus parainfluenzae en la periodontitis está relacionada con la inflamación intestinal en pacientes con enfermedad de Crohn. Por lo tanto, las personas con formas de periodontitis de inicio temprano pueden experimentar síntomas más graves de la enfermedad de Crohn (Imai et al., 2021); Sohn et al., 2023).
También se ha planteado la hipótesis de que la disbiosis de la microbiota intestinal influye en el desarrollo de la enfermedad periodontal, dado que la enfermedad inflamatoria intestinal es un factor de riesgo para la enfermedad periodontal (Chandan y Thomas, 2017). Esto puede deberse al hecho de que la disbiosis de la microbiota intestinal altera la función de la barrera intestinal, alterando el sistema inmunitario y provocando un aumento de los niveles de inflamación sistémica y, por tanto, afectando al metabolismo de la glucosa y los lípidos. Podría aumentar la probabilidad de desarrollar diversas enfermedades sistémicas (Jepsen et al., 2018).
Por último, cabe mencionar que, tras el tratamiento periodontal, la composición de la microbiota tanto oral como intestinal de los pacientes periodontales se asemejó mucho a la de los pacientes periodontalmente sanos (Baima et al., 2024).